Hoe om die skakelorde in chemie te bereken
Op die atoomvlak is die bindingsorde die aantal elektrone wat tussen twee atome verbind word. Byvoorbeeld, in die geval van dinitrogeen (N≡N) is die bindorde 3 omdat daar 3 chemiese bindings is wat die twee stikstofatome verbind. In die teorie van molekulêre orbitale word die bindorde ook gedefinieer as die helfte van die verskil tussen die aantal bindings- en antibonderende elektrone. Vir `n vinnige reaksie, moet jy net hierdie formule gebruik: bindende bevel = [(aantal elektrone in bindende molekules) - (aantal elektrone in molekules antibindende)] / 2
conținut
stappe
Metode 1
Verstaan die basiese skakel volgorde

1
Bepaal die skakel orde in `n oogopslag. `N Enkele kovalente binding, het `n bindende bevel 1- dubbel kovalente binding het `n bindende bevel 2- driedubbele kovalente binding het `n bindende bevel drie- en so aan. In sy mees basiese vorm is die bindingsbevel die aantal gekoppelde elektronpare wat twee atome bymekaar hou.

2
Oorweeg die manier waarop atome bymekaarkom om molekules te vorm. In `n gegewe molekule word die komponentatome verbind deur gekoppelde elektronpare. Hierdie elektrone sirkel om die kern van `n atoom in "orbitale", wat elk slegs twee elektrone kan akkommodeer. As `n orbitaal nie is nie "volle"Byvoorbeeld, slegs een elektron of geen elektron, dan gepaar elektrone kan nie bind aan die ooreenstemmende elektron uit `n ander atoom wat vry is.

3
Wanneer die naaste baan is vol, nuwe elektrone begin om te voldoen in die volgende baan verder vanaf die kern en voortgaan totdat die tweede baan is vol. Die versameling van elektrone gaan voort in breër orbitale, aangesien groter atome meer elektrone as klein atome het.

4
Teken die Lewis-punt of struktuurdiagram. Dit is `n baie nuttige hulpmiddel om te visualiseer hoe die atome van een molekuul gekoppel is aan dié van `n ander. Teken die atome deur hul onderskeie simbole te gebruik (byvoorbeeld H vir waterstof of Cl vir chloor). Dit illustreer die skakels wat tussen hulle bestaan deur lyne (byvoorbeeld - vir `n eenvoudige skakel, = vir `n dubbele skakel en ≡ vir `n driedubbele skakel). Merk die ongekoppelde elektrone en die elektronpare deur twee punte te gebruik (byvoorbeeld: C :). Sodra jy die Lewis-struktuur voltooi het, tel die aantal skakels: die resultaat sal die koppelvolgorde wees. Sodra jy jou Lewis-puntstruktuur geteken het, tel die aantal effekte: dit is die verbandorde.

5
Die Lewis dot struktuur van die dinitrogeen sou N≡N wees. Elke stikstofatoom bevat `n paar elektrone en drie elektrone sonder binding. Wanneer twee stikstofatome gevind word, meng die ses gebonde onbonde elektrone in `n kragtige drievoudige kovalente binding.
Metode 2
Bereken die skakel volgorde vir molekulêre orbitale teorie
1
- Kyk na `n diagram van elektronorbitale. Hou in gedagte dat die orbitale verder en verder weg van die kern van die atoom geleë is. Volgens die eiendom van entropie soek energie altyd die laagste moontlike orde van orde. Die elektrone sal poog om die laagste orbitale beskikbaar te stel.
- Hier is wat die verskil is tussen binding en antibondende orbitale. Wanneer twee atome bymekaarkom om `n molekuul te vorm, poog hulle om die ander se elektrone te gebruik om die laagste moontlike toestande in die elektronorbitale te vul. Bonding-elektrone is in wese die elektrone wat bymekaar hou en in die laagste energietoestande val. Die antibonderende elektrone is daardie elektrone "gratis" of onbondes wat na orbitale met hoër energietoestande gestoot word.

2
Verbindingselektrone: kyk orbitale is vol, jy kan bepaal hoeveel van die elektrone hoër energietoestande die mees stabiele baan kan vul met `n laer energie state, wat ooreenstem atoom. hierdie "elektrone wat orbitale vul" hulle staan bekend as bindingselektrone.

3
Leer die formule In molekulêre orbitale teorie word die bindorde gedefinieer as die helfte van die verskil tussen die hoeveelheid binding en antibondende elektrone: bindende bevel = [(aantal elektrone in bindende molekules) - (aantal elektrone in molekules antibindende)] / 2.

4
Elke elektron wat `n orbitaal van bindende molekules betree, help om die nuwe molekule te stabiliseer. Elke elektron wat `n orbitaal van antibonderende molekules binnedring, help om die nuwe molekule te destabiliseer. Oorweeg die nuwe energie toestand as die bindende volgorde van die molekule.
Deel op sosiale netwerke:
Verwante
 Hoe om die skakel energie te bereken
Hoe om die skakel energie te bereken Hoe om Organiese Chemie goed te keur
Hoe om Organiese Chemie goed te keur Hoe om `n reduksieoksiedreaksie (redox) te balanseer
Hoe om `n reduksieoksiedreaksie (redox) te balanseer Hoe om die persentasie massa te bereken
Hoe om die persentasie massa te bereken Hoe om die atoommassa te bereken
Hoe om die atoommassa te bereken Hoe om gram na mol te omskep
Hoe om gram na mol te omskep Hoe om die afskermingskonstante en die effektiewe kernlading te bepaal
Hoe om die afskermingskonstante en die effektiewe kernlading te bepaal Hoe om die polariteit van `n molekuul te bepaal
Hoe om die polariteit van `n molekuul te bepaal Hoe om die oplosbaarheid te bepaal
Hoe om die oplosbaarheid te bepaal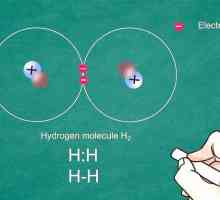 Hoe om Lewis-puntstrukture te teken
Hoe om Lewis-puntstrukture te teken Hoe om die atoomgetal te vind
Hoe om die atoomgetal te vind Hoe om die oksidasie nommer te vind
Hoe om die oksidasie nommer te vind Hoe om die aantal protone, neutrone en elektrone te vind
Hoe om die aantal protone, neutrone en elektrone te vind Hoe om valenselektrone te vind
Hoe om valenselektrone te vind Hoe om elektrone te vind
Hoe om elektrone te vind Hoe om elektroniese konfigurasies vir atome van enige element te skryf
Hoe om elektroniese konfigurasies vir atome van enige element te skryf Hoe om `n chemiese vergelyking te skryf
Hoe om `n chemiese vergelyking te skryf Hoe om die basiese beginsels van biochemie te bestudeer
Hoe om die basiese beginsels van biochemie te bestudeer Hoe om chemiese verbindings te noem
Hoe om chemiese verbindings te noem Hoe om `n moorspelling te gebruik
Hoe om `n moorspelling te gebruik Hoe om in anorganiese chemie te presteer
Hoe om in anorganiese chemie te presteer
 Hoe om Organiese Chemie goed te keur
Hoe om Organiese Chemie goed te keur Hoe om `n reduksieoksiedreaksie (redox) te balanseer
Hoe om `n reduksieoksiedreaksie (redox) te balanseer Hoe om die persentasie massa te bereken
Hoe om die persentasie massa te bereken Hoe om die atoommassa te bereken
Hoe om die atoommassa te bereken Hoe om gram na mol te omskep
Hoe om gram na mol te omskep Hoe om die afskermingskonstante en die effektiewe kernlading te bepaal
Hoe om die afskermingskonstante en die effektiewe kernlading te bepaal Hoe om die polariteit van `n molekuul te bepaal
Hoe om die polariteit van `n molekuul te bepaal Hoe om die oplosbaarheid te bepaal
Hoe om die oplosbaarheid te bepaal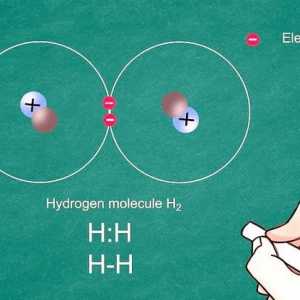 Hoe om Lewis-puntstrukture te teken
Hoe om Lewis-puntstrukture te teken Hoe om die atoomgetal te vind
Hoe om die atoomgetal te vind