Hoe om die persentasie opbrengs in chemie te bereken
Binne die veld van chemie, die teoretiese opbrengs
conținut
stappe
Deel 1
Vind die beperkende reagens

1
Begin met `n gebalanseerde chemiese vergelyking. `N Chemiese vergelyking beskryf `n chemiese reaksie van die reaktante (aan die linkerkant) om produkte (aan die regterkant) te vorm. In sommige probleme sal jy reeds hierdie vergelyking hê, terwyl dit in ander gevalle op jou eie moet geskryf word. Omdat atome nie tydens `n chemiese reaksie geskep of vernietig word nie, moet elke element dieselfde aantal atome aan die regterkant en linkerkant hê.
- Byvoorbeeld, suurstof en glukose kan reageer om koolstofdioksied en suurstof te vorm: →
Elke kant het presies 6 koolstofatome (C), 12 waterstofatome (H) en 18 suurstofatome (O). Op hierdie manier is die vergelyking gebalanseerd. - As jy wil weet hoe om `n vergelyking te balanseer, lees hierdie artikel.

2
Bereken die molêre massa van elke reagens. Bepaal die molêre massa van al die atome in die verbinding en voeg dan by om die molêre massa van dieselfde te vind. Voer hierdie prosedure uit om `n enkele molekuul van die genoemde verbinding te vind.

3
Verander die hoeveelheid van elke reaktant van gram na mol. Nou is die tyd om te fokus op die spesifieke eksperiment wat ons moet studeer. Teken die hoeveelhede van elke reagens in gram in en verdeel die waarde deur die molêre massa van die verbinding om die hoeveelheid na mol te omskep.

4
Bereken die verhouding van reaksies. Onthou dat `n mol net `n groot getal is wat chemici gebruik om molekules te tel. Nou weet jy hoeveel molekules van elke reagens jy begin het. Verdeel die mol een reaktant tussen die mol van die ander om die verhouding van die twee molekules te vind.

5
Vind die ideale verhouding vir die reaksie. Neem die gebalanseerde vergelyking wat jy vroeër geskryf het, wat die ideale proporsie molekules sal aandui. Wanneer die genoemde verhouding gebruik word, sal albei reagense gelyktydig verteer word.

6
Vergelyk die verhoudings om die beperkende reagens te vind. In `n chemiese reaksie word een van die reagense verteer voor die ander. Hierdie beperkende reagens bepaal die duur van die chemiese reaksie. Vergelyk dus beide proporsies wat jy bereken het om die beperkende reagens te identifiseer:
Deel 2
Bereken die teoretiese opbrengs

1
Identifiseer die verlangde produk. Die regterkant van `n chemiese vergelyking toon `n lys van die produkte wat deur `n chemiese reaksie geskep word. Elke produk het `n teoretiese opbrengs, dit wil sê die hoeveelheid produk wat u sou verwag om te verkry indien die reaksie totaal effektief was.
- Terug na die vorige voorbeeld, is dit nodig om die volgende reaksie te analiseer: → .Aan die regterkant van die vergelyking word twee produkte, koolstofdioksied en water getoon. Nou moet ons die koolstofdioksiedopbrengs bereken ().

2
Skryf die aantal mol van die beperkende reagens neer. Die teoretiese opbrengs van `n eksperiment is die hoeveelheid produk wat onder perfekte toestande geskep word. Om hierdie waarde te bereken, moet jy begin met die aantal mol van die beperkende reagens (hierdie proses word hierbo uiteengesit in die instruksies om die beperkende reagens te vind).

3
Vind die proporsie molekules in die produk en die reagens. Om dit te doen, neem die gebalanseerde vergelyking op. Vervolgens verdeel die aantal molekules van die verlangde produk deur die aantal molekules van die beperkende reagens.

4
Vermenigvuldig die verhouding met die hoeveelheid in die mol van die reagens. Die resultaat is die teoretiese opbrengs van die verlangde produk, uitgedruk in mol.

5
Verander die resultaat wat na gram behaal is. Vermenigvuldig die resultaat in moles deur die molêre massa van genoemde verbinding om die teoretiese opbrengs in gram te vind. In die meeste eksperimente is dit beter om die gram te gebruik.
Deel 3
Bereken die persentasie opbrengs

1
Dit verstaan die betekenis van persentasieprestasie perfek. Jy bereken die teoretiese opbrengs vergelyking aanvaar dat al was in perfekte toestand, wat nooit gebeur in `n ware eksperiment, omdat besoedeling en ander onvoorspelbare probleme kan veroorsaak dat sommige van die reagense in gebreke bly om die produk te word. Dit is die rede waarom sommige chemici drie verskillende konsepte gebruik om na prestasie te verwys:
- Die teoretiese opbrengs is die maksimum hoeveelheid produk wat die eksperiment kan genereer.
- Werklike prestasie is die werklike bedrag wat jy geskep het, direk gemeet op grond van `n skaal.
- Die persentasie opbrengs formule is soos volg
Byvoorbeeld, `n persentasie opbrengs van 50% dui aan dat jy aan die einde van `n chemiese reaksie `n maksimum van 50% van die verwagte hoeveelheid kry.

2
Skryf die werklike prestasie van die eksperiment. As jy die eksperiment op jou eie gedoen het, versamel die gesuiwerde produk uit die reaksie en weeg dit op `n skaal om die massa daarvan te bereken. Aan die ander kant, as dit `n oefening of taak is, moet jy reeds die werklike prestasie-inligting hê.

3
Verdeel die werklike opbrengs tussen die teoretiese opbrengs. Maak seker dat jy dieselfde eenheid vir beide waardes gebruik (gewoonlik gram). Die resultaat sal `n verhouding minder as eenheid wees.

4
Vermenigvuldig die resultaat wat deur 100 verkry is om dit om te skakel in `n persentasie. Die antwoord sal die persentasie opbrengs wees.
wenke
- Sommige studente verwar die term Persentasie opbrengs (die resultaat verkry uit die maksimum moontlike hoeveelheid) met die persentasie fout (die verskil tussen `n eksperimentele uitslag van die verwagte resultaat). Die korrekte formule vir die persentasie opbrengs is
As jy egter beide opbrengste aftrek, gebruik jy die formule om die persentasie fout te vind. - As jy wye verskillende resultate kry, gaan die eenhede na. As die werklike opbrengs verskil van die teoretiese opbrengs met `n orde van grootte of meer, het u waarskynlik die verkeerde eenhede op een of ander stadium in die berekening gebruik. Herhaal die prosedures en hou rekord van die eenhede in elke stap van die vergelyking.
- As die persentasie opbrengs groter is as 100% (en jy weet seker dat die berekeninge korrek is), beteken dit dat daar ander stowwe is wat die produk besoedel het. Daarom moet jy dit skoonmaak (byvoorbeeld deur te droog of te filter) en weeg dit weer.
Deel op sosiale netwerke:
Verwante
 Hoe om die skakel energie te bereken
Hoe om die skakel energie te bereken Hoe om chemiese vergelykings te balanseer
Hoe om chemiese vergelykings te balanseer Hoe om `n reduksieoksiedreaksie (redox) te balanseer
Hoe om `n reduksieoksiedreaksie (redox) te balanseer Hoe om die spesifieke hitte te bereken
Hoe om die spesifieke hitte te bereken Hoe om die massa persentasie te bereken
Hoe om die massa persentasie te bereken Hoe om die konsentrasie van `n oplossing te bereken
Hoe om die konsentrasie van `n oplossing te bereken Hoe om `n chemiese vergelyking te skryf
Hoe om `n chemiese vergelyking te skryf Hoe stoichiometrie te doen
Hoe stoichiometrie te doen Hoe om Delta H (entalpie) te vind
Hoe om Delta H (entalpie) te vind Hoe om dividende te bereken
Hoe om dividende te bereken Hoe om die betaling van `n koepon te bereken
Hoe om die betaling van `n koepon te bereken Hoe om die rentebetaling op `n bonus te bereken
Hoe om die rentebetaling op `n bonus te bereken Hoe om die geannualiseerde opbrengs van `n beleggingsportefeulje te bereken
Hoe om die geannualiseerde opbrengs van `n beleggingsportefeulje te bereken Hoe om die opbrengs op kapitaal te bereken
Hoe om die opbrengs op kapitaal te bereken Hoe om die totale opbrengs van `n bonus te bereken
Hoe om die totale opbrengs van `n bonus te bereken Hoe om finansiële winsgewendheid te bereken (RF)
Hoe om finansiële winsgewendheid te bereken (RF) Hoe om die effektiewe rentekoers te bereken
Hoe om die effektiewe rentekoers te bereken Hoe om die volhoubare groeikoers te bereken
Hoe om die volhoubare groeikoers te bereken Hoe om opbrengs op die vervaldatum van `n verband te bereken
Hoe om opbrengs op die vervaldatum van `n verband te bereken Hoe om `n bonus te bepaal
Hoe om `n bonus te bepaal Hoe om `n kwartaallikse opbrengs te jaarstateer
Hoe om `n kwartaallikse opbrengs te jaarstateer
 Hoe om chemiese vergelykings te balanseer
Hoe om chemiese vergelykings te balanseer Hoe om `n reduksieoksiedreaksie (redox) te balanseer
Hoe om `n reduksieoksiedreaksie (redox) te balanseer Hoe om die spesifieke hitte te bereken
Hoe om die spesifieke hitte te bereken Hoe om die massa persentasie te bereken
Hoe om die massa persentasie te bereken Hoe om die konsentrasie van `n oplossing te bereken
Hoe om die konsentrasie van `n oplossing te bereken Hoe om `n chemiese vergelyking te skryf
Hoe om `n chemiese vergelyking te skryf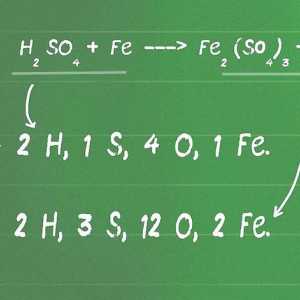 Hoe stoichiometrie te doen
Hoe stoichiometrie te doen Hoe om Delta H (entalpie) te vind
Hoe om Delta H (entalpie) te vind Hoe om dividende te bereken
Hoe om dividende te bereken Hoe om die betaling van `n koepon te bereken
Hoe om die betaling van `n koepon te bereken