Hoe om die molekulêre formule te vind
Die molekulêre formule is `n belangrike data vir elke chemiese verbinding, aangesien dit inligting verskaf oor watter atome en hoeveel van hulle in die verbinding teenwoordig is. Om die molekulêre formule te bereken, is dit nodig om die empiriese formule te hê, asook om te weet dat die verskil tussen beide formules `n integer vermenigvuldiger is.
conținut
stappe
Deel 1
Verkry die molekulêre formule uit die empiriese formule

1
Ken die verband tussen molekulêre en empiriese formules. Laasgenoemde gee jou die verhouding tussen atome in `n molekuul (byvoorbeeld twee suurstofatome vir elke koolstofatoom). Die molekulêre formule dui aan hoeveel atome van elke tipe in die molekuul is (byvoorbeeld, een koolstof en twee suurstof in die geval van koolstofdioksied). Albei formules word deur `n deel van `n heelgetal gekoppel sodat die molekulêre formule deur die empiriese formule vermenigvuldig word.

2
Bereken die hoeveelheid mol gas. Dit verwys na die gebruik van die wet van ideale gasse. U kan die druk, volume en temperatuur wat u van eksperimentele data verkry, gebruik om die hoeveelheid mol te bepaal. Hierdie bedrag word bereken met die volgende formule: n = PV / RT.

3
Bereken die molekulêre gewig van die gas. Jy kan dit net doen sodra jy die hoeveelheid mol gas wat by die wet van ideale gasse teenwoordig is, gevind het. Ook moet jy die hoeveelheid gram wat teenwoordig is, weet. Dan moet jy hierdie hoeveelheid gas in gram verdeel tussen die mol gas wat teenwoordig is om die molekulêre gewig te verkry.

4
Voeg die atoomgewig van al die atome in die empiriese formule by. Elke atoom in die empiriese formule het sy eie atoomgewig, wat in die onderste deel van die atoom se vierkant op die periodieke tabel voorkom. U kan die gewig van die empiriese formule kry deur al hierdie gewigte by te voeg.

5
Bepaal die verhouding tussen die gewigte van die molekulêre en empiriese formule. Deur dit te doen, kan jy bepaal hoeveel keer die empiriese gewig in die ware molekule herhaal word. As jy dit weet, kan jy die aantal kere bereken wat die empiriese formule in die molekulêre formule herhaal word. Hierdie aantal kere moet `n heelgetal wees. As dit nie die geval is nie, moet jy dit omdraai.

6
Vermenigvuldig die empiriese formule volgens proporsie. Vermenigvuldig die inskrywings van die empiriese formule deur die verhouding om die molekulêre formule te verkry. Hou in gedagte dat enige verbinding waarvan die verhouding 1 is, dieselfde molekulêre en empiriese formule sal hê.
Deel 2
Vind die empiriese formule

1
Vind die massa van elk van die atome wat teenwoordig is. Soms sal jy die massa van elke atoom kry, terwyl dit in ander voorkom as `n persentasie massa. In laasgenoemde geval moet u aanvaar dat dit `n monster van 100 g van die verbinding is sodat u die persentasie massa as `n werklike massa in gram kan skryf.
- Voorbeeld: 75,46 g C- 8,43 g O-16,11 g H

2
Verander die massa na mol. Dit is nodig om die molekulêre massas van elke element na mol te omskep. Om dit te kan doen, moet jy die laasgenoemde tussen die atoommassas van elke element verdeel. Die atoommassa word in die onderste deel van die elementkas in die periodieke tabel getoon.

3
Verdeel al die molêre waardes tussen die kleinste molêre waarde. U moet die hoeveelheid mol van elke individuele element verdeel deur die kleinste molêre hoeveelheid van al die elemente wat in die verbinding teenwoordig is. Op hierdie manier kan jy die eenvoudigste verhoudings van mol vind. Dit werk omdat dit die element van die minste oorvloed as 1 stel en u `n ooreenstemmende verhouding gee vir die ander elemente van die verbinding.

4
Rond die molêre waardes om heelgetalle te kry. Hierdie getalle sal die inskrywings van die empiriese formule word. U moet hulle na die naaste heelgetal omsluit en sodra u hierdie nommers verwerf het, kan u die empiriese formule skryf.
Deel 3
Verstaan chemiese formules

1
Verstaan die empiriese formules. `N Empiriese formule gee jou inligting oor die verhoudings tussen een atoom en die ander in `n molekuul, maar vertel jou nie van die presiese aantal atome wat in die molekuul voorkom nie. Die empiriese formule gee jou ook nie inligting oor die struktuur en skakels tussen atome in `n molekuul nie.

2
Weet wat die molekulêre formule aandui. Hierdie formule, soos die empiriese formule, gee jou nie inligting oor die skakels en struktuur van `n molekuul nie, maar in teenstelling met die empiriese formule gee dit jou besonderhede oor die hoeveelheid atome van elke tipe wat teenwoordig is. in die molekule. Die empiriese en molekulêre formule word verwant aan die verhouding van `n heelgetal.

3
Dit sluit die strukturele voorstellings in. Dit gee u nog meer inligting as die molekulêre formules, aangesien hulle nie net die hoeveelheid van elke tipe atoom wat in `n molekuul voorkom nie, wys, maar hulle ook u inlig oor die skakels en struktuur van `n molekuul wat data uitmaak fundamenteel vir die begrip van hoe die molekule sal reageer.
wenke
- Lees die probleem of die data sorgvuldig deur.
waarskuwings
- Jy moet nie die empiriese formule verwar met die molekulêre een nie (of andersom).
Dinge wat jy nodig het
- Periodieke tabel van elemente
- sakrekenaar
- potlood
- papier
Deel op sosiale netwerke:
Verwante
 Hoe om teks in Microsoft Excel te versoen
Hoe om teks in Microsoft Excel te versoen Hoe om selle in `n Google Docs-sigblad te verdeel
Hoe om selle in `n Google Docs-sigblad te verdeel Hoe om die inhoud van alkohol in die bloed te bereken (formule van Widmark)
Hoe om die inhoud van alkohol in die bloed te bereken (formule van Widmark) Hoe om chemiese vergelykings te balanseer
Hoe om chemiese vergelykings te balanseer Hoe om die spesifieke hitte te bereken
Hoe om die spesifieke hitte te bereken Hoe om die skakelorde in chemie te bereken
Hoe om die skakelorde in chemie te bereken Hoe om die persentasie massa te bereken
Hoe om die persentasie massa te bereken Hoe om die massa persentasie te bereken
Hoe om die massa persentasie te bereken Hoe om die molêre massa te bereken
Hoe om die molêre massa te bereken Hoe om normaliteit te bereken
Hoe om normaliteit te bereken Hoe om gram na mol te omskep
Hoe om gram na mol te omskep Hoe om grade Fahrenheit om te skakel na Kelvin grade
Hoe om grade Fahrenheit om te skakel na Kelvin grade Hoe om `n netto ioniese vergelyking te skryf
Hoe om `n netto ioniese vergelyking te skryf Hoe om `n chemiese vergelyking te skryf
Hoe om `n chemiese vergelyking te skryf Hoe om wiskunde en fisika formules te memoriseer
Hoe om wiskunde en fisika formules te memoriseer Hoe om die kinetiese energie formule te verkry
Hoe om die kinetiese energie formule te verkry Hoe om die empiriese formule te verkry
Hoe om die empiriese formule te verkry Hoe om die kwadratiese formule te kry
Hoe om die kwadratiese formule te kry Hoe om die afstand formule te gebruik om die lengte van `n lyn te vind
Hoe om die afstand formule te gebruik om die lengte van `n lyn te vind Hoe om die standaardafwyking in Excel te bereken
Hoe om die standaardafwyking in Excel te bereken Hoe om `n pasgemaakte veld in `n draaitabel by te voeg
Hoe om `n pasgemaakte veld in `n draaitabel by te voeg
 Hoe om selle in `n Google Docs-sigblad te verdeel
Hoe om selle in `n Google Docs-sigblad te verdeel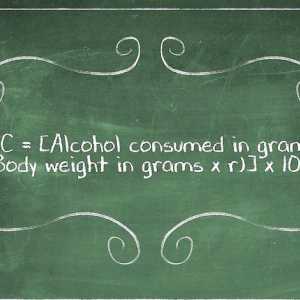 Hoe om die inhoud van alkohol in die bloed te bereken (formule van Widmark)
Hoe om die inhoud van alkohol in die bloed te bereken (formule van Widmark) Hoe om chemiese vergelykings te balanseer
Hoe om chemiese vergelykings te balanseer Hoe om die spesifieke hitte te bereken
Hoe om die spesifieke hitte te bereken Hoe om die skakelorde in chemie te bereken
Hoe om die skakelorde in chemie te bereken Hoe om die persentasie massa te bereken
Hoe om die persentasie massa te bereken Hoe om die massa persentasie te bereken
Hoe om die massa persentasie te bereken Hoe om die molêre massa te bereken
Hoe om die molêre massa te bereken Hoe om normaliteit te bereken
Hoe om normaliteit te bereken Hoe om gram na mol te omskep
Hoe om gram na mol te omskep