Hoe om die periodieke tabel van die elemente te lees
Die periodieke tabel van die elemente bevat die lys van die 109 elemente wat tot dusver ontdek is. Daar is verskillende simbole en getalle wat die verskille tussen die elemente identifiseer, terwyl die struktuur van die tabel die elemente met ooreenkomste groepeer. U kan die periodieke tabel lees met inagneming van die volgende instruksies.
conținut
stappe
Deel 1
Verstaan die struktuur

1
Kyk na die periodieke tabel van links bo na die einde van die laaste ry, naby die onderkant. Die tafel is gestruktureer van regs na links in stygende volgorde van die atoomgetal. Die atoomgetal is die aantal protone in `n enkele atoom.
- Nie alle kolomme of rye is voltooi nie. Alhoewel daar leë spasies in die middel is, sal die lees van die tafel van links na regs voortgaan. Byvoorbeeld, Waterstof het die atoomgetal 1 en is links bo. Die helium het die atoomgetal 2 en is regs bo.
- Elemente van 57 tot 102 word gewoonlik aangedui as `n subgroep in die onderste regterkantste gedeelte van die tabel. Dit word seldsame aardse genoem.

2
Vind `n "groep" van elemente in elke kolom van die tabel. Daar is 18 kolomme.


3
Vind `n "periode" van die elemente in elke ry van die tabel. Daar is 7 periodes. Gebruik die frase `lees `n tydperk langs` om van links na regs te lees.

4
Dit bestaan uit die bykomende groepe metale, semimetale en nie-metale. Die kleure sal aansienlik verander.

5
Oorweeg dat die elemente soms ook in families gegroepeer word. Dit is alkalimetale (1A), alkaliese aardmetale (2A), halogene (7A), edelgasse (8A) en koolstowwe (4A).
Deel 2
Lees die simbool en die naam

1
Lees eers die simbool. Dit is `n kombinasie van 1 tot 2 letters wat as standaard in verskillende tale gebruik word.
- Die simbool kan afgelei word uit die Latynse naam van die element of die algemeen aanvaarde algemene naam.
- In baie gevalle is die simbool baie soortgelyk aan die naam in Spaans, soos Helium, wie se simbool "Hy" is. Dit is egter nie `n reël om te volg nie. Byvoorbeeld: yster is `geloof`. Om hierdie rede word die simbool- en naamkombinasie gereeld gememoriseer vir vinnige verwysing.

2
Kyk na die algemene naam. Dit sal net onder die simbool verskyn en sal verander afhangende van die taal waarin die periodieke tabel geskryf word.
Deel 3
Lees die atoomgetal

1
Lees die periodieke tabel deur die atoomgetal in die boonste sentrum of bokant van elke itemkassie te volg. Soos voorheen genoem, gaan dit van links bo na regs. Die vinnigste manier om meer inligting oor die element te kry, is om sy atoomgetal te ken.

2
Verstaan dat die atoomgetal die aantal protone in die kern van `n enkele atoom van die element is.

3
Verstaan dat protons byvoeg of verwyder word, sal `n ander element genereer.

4
Om die aantal protone in `n atoom te vind, beteken ook om die aantal elektrone te vind. Atome het `n gelyke aantal elektrone en protone.
Deel 4
Lees die atoomgewig

1
Vind die atoomgewig. Dit is die getal onder die algemene naam van die element.
- Alhoewel dit lyk asof die atoomgewig van die boonste regs na die linkerkant in getal toeneem, is dit nie van toepassing op alle gevalle nie.

2
Verstaan dat die meeste items met desimale getoon sal word. Die atoomgewig is die totaal van deeltjies in die kern - dit is egter `n benaderde gewig van verskillende isotope.

3
Gebruik die atoomgewig om die aantal neutrone in `n enkele atoom te vind. Rond die atoomgewig na die volgende heelgetal, die massa nommer genoem. Trek dan die aantal protone na die massa nommer om die aantal neutrone te kry.
Deel op sosiale netwerke:
Verwante
 Hoe om kolomme in InDesign aan te pas
Hoe om kolomme in InDesign aan te pas Hoe om `n eenvoudige tabel in Microsoft Word te skep
Hoe om `n eenvoudige tabel in Microsoft Word te skep Hoe om `n tabel in `n Microsoft Word-dokument in te voeg
Hoe om `n tabel in `n Microsoft Word-dokument in te voeg Hoe om `n tafel te trek
Hoe om `n tafel te trek Hoe om die persentasie massa te bereken
Hoe om die persentasie massa te bereken Hoe om die atoommassa te bereken
Hoe om die atoommassa te bereken Hoe om die molêre massa te bereken
Hoe om die molêre massa te bereken Hoe om gram na mol te omskep
Hoe om gram na mol te omskep Hoe om die atoomgetal te vind
Hoe om die atoomgetal te vind Hoe om die aantal neutrone in `n atoom te vind
Hoe om die aantal neutrone in `n atoom te vind Hoe om die aantal protone, neutrone en elektrone te vind
Hoe om die aantal protone, neutrone en elektrone te vind Hoe om valenselektrone te vind
Hoe om valenselektrone te vind Hoe om elektrone te vind
Hoe om elektrone te vind Hoe om die molekulêre formule te vind
Hoe om die molekulêre formule te vind Hoe om elektroniese konfigurasies vir atome van enige element te skryf
Hoe om elektroniese konfigurasies vir atome van enige element te skryf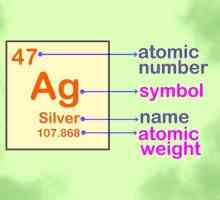 Hoe om die periodieke tabel te memoriseer
Hoe om die periodieke tabel te memoriseer Hoe om chemiese verbindings te noem
Hoe om chemiese verbindings te noem Hoe om in anorganiese chemie te presteer
Hoe om in anorganiese chemie te presteer Hoe om elektronegatiwiteit te bereken
Hoe om elektronegatiwiteit te bereken Hoe om `n tafel in InDesign by te voeg
Hoe om `n tafel in InDesign by te voeg Hoe om die verskil in `n spiltafel te bereken
Hoe om die verskil in `n spiltafel te bereken
 Hoe om `n eenvoudige tabel in Microsoft Word te skep
Hoe om `n eenvoudige tabel in Microsoft Word te skep Hoe om `n tabel in `n Microsoft Word-dokument in te voeg
Hoe om `n tabel in `n Microsoft Word-dokument in te voeg Hoe om `n tafel te trek
Hoe om `n tafel te trek Hoe om die persentasie massa te bereken
Hoe om die persentasie massa te bereken Hoe om die atoommassa te bereken
Hoe om die atoommassa te bereken Hoe om die molêre massa te bereken
Hoe om die molêre massa te bereken Hoe om gram na mol te omskep
Hoe om gram na mol te omskep Hoe om die atoomgetal te vind
Hoe om die atoomgetal te vind Hoe om die aantal neutrone in `n atoom te vind
Hoe om die aantal neutrone in `n atoom te vind Hoe om die aantal protone, neutrone en elektrone te vind
Hoe om die aantal protone, neutrone en elektrone te vind