Hoe om chemiese vergelykings te balanseer
`N Chemiese vergelyking is `n geskrewe simboliese voorstelling van `n chemiese reaksie. Die reaktiewe chemikalie (s) is aan die linkerkant en die chemiese (e) wat voorkom, is aan die regterkant.
Die wet van die behoud van materie bepaal dat geen atoom kan geskep of vernietig word in `n chemiese reaksie, so die aantal atome teenwoordig is in die reaktante moet die aantal atome teenwoordig is in die produkte gelyk.
Volg hierdie gids om te leer hoe om chemiese vergelykings anders te balanseer.
stappe
Metode 1
Tradisionele swaai

1
Skryf die gegewe vergelyking neer. Vir hierdie voorbeeld sal jy die volgende gebruik:
- C3H8 + O2 --> H2O + CO2.
- Hierdie reaksie vind plaas wanneer propaan (C3H8) brand in die teenwoordigheid van suurstof om water en koolstofdioksied te produseer.

2
Noteer die aantal atome vir elke element wat jy aan beide kante van die vergelyking het. Kyk na die inskrywings langs elke atoom om die aantal atome in die vergelyking te vind.

3
Verlaat altyd waterstof en suurstof tot die einde.

4
As jy meer as een element het om te balanseer, kies die element wat in `n enkele reagensmolekule en in `n enkele produkmolekule voorkom. Dit beteken dat jy eers die koolstofatome moet balanseer.

5
Voeg `n koëffisiënt by die koolstofatoom regs van die vergelyking om dit te balanseer met die 3 koolstofatome aan die linkerkant van die vergelyking.

6
Balanseer die waterstofatome as die volgende stap. Jy het 8 aan die linkerkant, so jy sal 8 aan die regterkant nodig hê.


7
Balanseer die suurstofatome.

Metode 2
Algebraïese balansering

1
Teken die vergelyking op volgens simbool en formule. Kom ons sê dat a = 1, skryf dan die vergelyking gebaseer op die formule.

2
Vervang die nommers vir hul veranderlike.

3
Gaan die aantal items aan die kant van die reagense en ook aan die kant van die produkte.

wenke
- Onthou om te vereenvoudig.
- As jy vas is, kan jy die vergelyking op `n aanlynwebwerf skryf wat dit vir jou sal balanseer. Onthou net dat jy nie toegang tot hierdie eksamen sal hê as jy `n eksamen neem nie, moenie daardeur afhanklik wees nie.
waarskuwings
- Gedurende die rollende proses, kan jy breuke gebruik om te help, maar die vergelyking is nie gebalanseer word indien daar nog koëffisiënte deur breuke.
- Om van die breuke ontslae te raak, vermenigvuldig die hele vergelyking (beide die linker en die regterkant) met die nommer in die noemer van jou breuk.
- Moet nooit breuke as koëffisiënte in `n chemiese vergelyking gebruik nie - jy sal nooit `n halwe molekule of `n halwe atoom in `n chemiese reaksie skep nie.
verwysings
Deel op sosiale netwerke:
Verwante
 Hoe om die skakel energie te bereken
Hoe om die skakel energie te bereken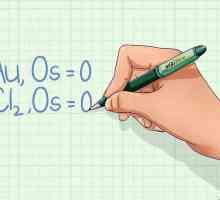 Hoe om `n reduksieoksiedreaksie (redox) te balanseer
Hoe om `n reduksieoksiedreaksie (redox) te balanseer Hoe om die persentasie massa te bereken
Hoe om die persentasie massa te bereken Hoe om die massa persentasie te bereken
Hoe om die massa persentasie te bereken Hoe om die persentasie opbrengs in chemie te bereken
Hoe om die persentasie opbrengs in chemie te bereken Hoe om die atoommassa te bereken
Hoe om die atoommassa te bereken Hoe om die molêre massa te bereken
Hoe om die molêre massa te bereken Hoe om gram na mol te omskep
Hoe om gram na mol te omskep Hoe om die atoomgetal te vind
Hoe om die atoomgetal te vind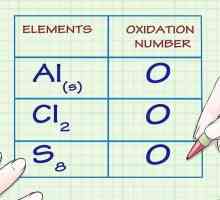 Hoe om die oksidasie nommer te vind
Hoe om die oksidasie nommer te vind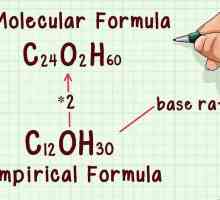 Hoe om die molekulêre formule te vind
Hoe om die molekulêre formule te vind Hoe om E = mc2 te verstaan
Hoe om E = mc2 te verstaan Hoe om elektroniese konfigurasies vir atome van enige element te skryf
Hoe om elektroniese konfigurasies vir atome van enige element te skryf Hoe om `n netto ioniese vergelyking te skryf
Hoe om `n netto ioniese vergelyking te skryf Hoe om `n chemiese vergelyking te skryf
Hoe om `n chemiese vergelyking te skryf Hoe stoichiometrie te doen
Hoe stoichiometrie te doen Hoe om Delta H (entalpie) te vind
Hoe om Delta H (entalpie) te vind Hoe om chemiese verbindings te noem
Hoe om chemiese verbindings te noem Hoe om die empiriese formule te verkry
Hoe om die empiriese formule te verkry Hoe om in anorganiese chemie te presteer
Hoe om in anorganiese chemie te presteer Hoe om elektronegatiwiteit te bereken
Hoe om elektronegatiwiteit te bereken
 Hoe om `n reduksieoksiedreaksie (redox) te balanseer
Hoe om `n reduksieoksiedreaksie (redox) te balanseer Hoe om die persentasie massa te bereken
Hoe om die persentasie massa te bereken Hoe om die massa persentasie te bereken
Hoe om die massa persentasie te bereken Hoe om die persentasie opbrengs in chemie te bereken
Hoe om die persentasie opbrengs in chemie te bereken Hoe om die atoommassa te bereken
Hoe om die atoommassa te bereken Hoe om die molêre massa te bereken
Hoe om die molêre massa te bereken Hoe om gram na mol te omskep
Hoe om gram na mol te omskep Hoe om die atoomgetal te vind
Hoe om die atoomgetal te vind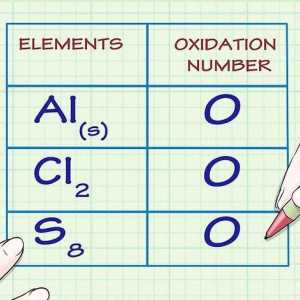 Hoe om die oksidasie nommer te vind
Hoe om die oksidasie nommer te vind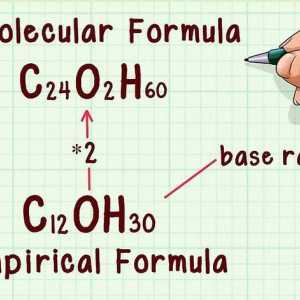 Hoe om die molekulêre formule te vind
Hoe om die molekulêre formule te vind