Hoe om die oksidasie nommer te vind
In chemie verwys die terme "oksidasie" en "reduksie" na reaksies waarin `n atoom (of `n groep atome) onderskeidelik elektrone verloor of wen. Oksidasiegetalle is getalle toegeken aan atome (of groepe atome) wat chemici help om tred te hou met hoeveel elektrone beskikbaar is vir oordrag en of reagense binne `n reaksie geoksideer of verminder word. Die proses om oksidasiegetalle aan atome toe te ken, kan wissel van buitengewoon eenvoudige tot ietwat komplekse, afhangende van die ladings van die atome en die chemiese samestelling van die molekules waarvan hulle deel is. Om dinge te kompliseer, kan sommige atome meer as een oksidasiegetal hê. Gelukkig word die toewysing van oksidasiegetalle beheer deur goed gedefinieerde reëls en maklik om te volg. Alhoewel die bekendmaking van basiese chemie en algebra dit makliker sal maak om hierdie reëls te gebruik.
stappe
Deel 1
Ken die oksidasie nommer toe op grond van die chemiese reëls
1
Bepaal of die betrokke stof elementêr is. Die vry elementêre atome wat nie gekombineer word nie, het altyd `n oksidasiegetal gelyk aan 0. Dit geld vir atome waarvan die elementêre vorm uit `n enkele atoom bestaan en ook vir atome waarvan die elementêre vorm diatomies of poliatomies is.
- Byvoorbeeld, die Al(S) en die Cl2 hulle het `n oksidasiegetal van 0 omdat hulle in hul elementêre vorm is sonder om te kombineer.
- Let daarop dat die elementêre vorm van swael, S8 (of octosulfide), hoewel dit onreëlmatig is, het dit ook `n oksidasiegetal van 0.
2
Bepaal of die betrokke stof `n ioon is. Die ione het `n oksidasiegetal gelyk aan dié van hul lading. Dit geld vir ione wat nie aan enige ander element gekoppel is nie en ook vir diegene wat deel van `n ioniese verbinding is.
Byvoorbeeld, die Cl ion het `n oksidasiegetal van -1.Cl ion bly `n oksidasiegetal van -1 wanneer dit deel van die NaCl-verbinding is. Omdat die Na-ion per definisie `n lading van +1 het, weet ons dat die Cl ion `n lading van -1 het, dus is die oksidasiegetal nog -1.3
Vir metaalione moet jy in gedagte hou dat verskeie oksidasiegetalle moontlik is. Baie metaalelemente het meer as een lading. Byvoorbeeld, die metaal yster (Fe) kan `n ioon wees met `n lading van +2 of +3. Die aanklag van metaalione (en dus hul oksidasiegetalle) kan bepaal word met inagneming van die vrag van die ander atome in die saamgestelde vorm of wanneer dit geskryf is in `n teks, die waarneming van die notasie in Romeinse syfers (soos in sin, "Die yster ioon (III) het `n lading van +3").
Kom ons ondersoek byvoorbeeld `n verbinding wat die aluminiummetaalioon bevat. Die AlCl-verbinding3 het `n gemiddelde las 0. Soos ons reeds weet dat Cl ione `n lading het -1 en daar is 3 Cl ione in die verbinding, moet die Al-ion `n lading van +3 hê sodat die gemiddelde lading van al die ione tot 0 kan toevoeg. Daarom is die oksidasiegetal van Al +3.4
Ken `n oksidasiegetal van -2 toe aan suurstof (met uitsonderings). in Byna alle gevalle het die suurstofatome `n oksidasiegetal van -2. Daar is enkele uitsonderings op hierdie reël:
Wanneer suurstof in sy elementêre toestand is (O2), sy oksidasiegetal is 0, soos dit met al die elementêre atome is.Wanneer suurstof deel van a is peroksied, die oksidasiegetal is -1. Peroksiede is `n klas van verbindings wat `n eenvoudige suurstof-suurstofbinding (of die peroksiedanion O bevat)2). Byvoorbeeld, in die molekuul H2O2 (waterstofperoksied), suurstof het `n oksidasiegetal (en `n lading) van -1.Wanneer suurstof aan fluor gebind is, is die oksidasiegetal +2. Lees die fluorienreël later vir meer inligting. 5
Ken `n oksidasiegetal van +1 aan waterstof toe (met uitsonderings). Soos suurstof, verander die oksidasiegetal van waterstof slegs in uitsonderlike gevalle. Oor die algemeen het waterstof `n oksidasiegetal van +1 (tensy, soos hierbo genoem, is dit in sy elementêre vorm, H2). In die spesiale geval van hidried verbindings het waterstof egter `n oksidasiegetal van -1.
Byvoorbeeld, in H2Of ons weet dat waterstof `n oksidasiegetal van +1 het omdat suurstof `n lading van -1 het en ons benodig 2 ladings +1 vir die totale lading van die verbinding om nul te wees. In natriumhidried, NaH, het waterstof egter `n oksidasiegetal -1 omdat die Na-ion `n lading van +1 het, en vir die totale lading van die verbinding om 0 te wees, is die lading (en dus, die oksidasiegetal) moet -1 wees.6
fluoor het altyd `n oksidasiegetal van -1. Soos hierbo genoem, kan die oksidasiegetalle van sekere elemente wissel volgens verskillende faktore (metaalione, suurstofatome in peroksiede, ens.). Fluoried het egter `n oksidasiegetal van -1 wat nooit verander nie. Dit is omdat fluoor is die mees elektronegatiewe element of, met ander woorde, is die element wat minder geneig om enige van hul eie elektrone lewer en het meer geleentheid om `n elektron uit `n ander atoom. Daarom verander jou lading nie.
7
Stel die oksidasiegetal van `n verbinding wat gelyk is aan die lading. Die som van die oksidasiegetalle van al die atome van `n verbinding moet dieselfde waarde hê as die lading van die verbinding. Byvoorbeeld, as `n verbinding geen koste het nie, moet die som van die oksidasiegetalle van sy atome 0 wees. As die verbinding `n polyatomiese ioon is met lading -1, moet die oksidasiegetalle -1, ens. Byvoeg.
Dit is `n goeie manier om jou werk te verifieer, as die oksidasie van jou verbinding nie gelyk is aan die las van die verbinding nie, dan kan jy weet dat jy `n aantal (of verskeie) verkeerd toegeken het.Deel 2
Tel getalle aan atome sonder om reëls van oksidasiegetalle te gebruik
1
Bepaal atome waar die reëls van oksidasiegetalle nie van toepassing is nie. Sommige atome het nie spesifieke reëls oor die oksidasiegetalle wat hulle kan verkry nie. As jou atoom nie in die hierbo beskryf reëls en nie seker is wat jou vrag (byvoorbeeld, as dit is deel van `n groot mengsel en dus individuele vragte nie getoon), kan jy die oksidasiegetal vind deur die proses van eliminasie. Eerstens moet jy die oksidasie van die ander atome van die verbinding bepaal, en dan eenvoudig die onbekende atoom oplos op grond van die totale lading van die verbinding.
- Byvoorbeeld, in die verbinding Na2SW4, Die beheer van swael (S) is nie bekend nie (dit is nie in sy elementêre vorm nie, dus is dit nie 0 nie, maar dit is alles wat ons weet). Dit is `n goeie kandidaat vir hierdie algebraïese metode om `n oksidasiegetal te bepaal.
2
Vind die bekende oksidasiegetal van die ander elemente van die verbinding. Gebruik die reëls vir die opdrag van oksidasiegetalle, dien oksidasiegetalle toe aan die ander atome van die verbinding. Bly gerus vir uitsonderlike gevalle vir O, H, ens.
In die Na2SW4, Ons weet dat, op grond van die reëls, die Na-ion `n lading (en dus `n oksidasiegetal) van +1 het en die suurstofatome `n oksidasiegetal van -2 het.3
Vermenigvuldig die getal van elke atoom deur sy oksidasiegetal. Noudat ons die oksidasiegetalle van alle atome behalwe die onbekende ken, moet ons in gedagte hou dat sommige van hierdie atome meer as een keer kan verskyn. Vermenigvuldig die numeriese koëffisiënt van elke atoom (geskryf in aantekeninge na die chemiese simbool van die atoom in die verbinding) deur sy oksidasiegetal.
In die Na2SW4, Ons weet dat daar twee atome van Na en C4 moet O. 2 keer vermenigvuldig 1, oksidasie van Na, te verkry 2, en vermenigvuldig 4 keer -2, oksidasie van O te verkry -8.4
Voeg die resultate by. Voeg die resultate van die produkte by, gee die oksidasie nommer van die verbinding sonder om die oksidasiegetal van die atoom te oorweeg wat jy nie ken nie.
In ons Na voorbeeld2SW4, ons moet 2 tot 8 voeg om -6 te kry.5
Bereken die onbekende oksidasiegetal gebaseer op die lading van die verbinding. Nou het jy alles wat jy nodig het om die onbekende oksidasiegetal te vind deur eenvoudige algebra te gebruik. Stel `n vergelyking wat die antwoord van die vorige stap het, bygevoeg aan die onbekende oksidasiegetal, gelyk aan die totale lading van die verbinding. Met ander woorde: (Som van die bekende oksidasiegetalle) + (onbekende oksidasiegetal wat u wil verkry) = (komponent lading).
In ons Na voorbeeld2SW4 ons moet die oplossing op die volgende manier vind:(Som van die bekende oksidasiegetalle) + (onbekende oksidasiegetal wat u wil verkry) = (komponent lading)-6 + S = 0S = 0 + 6S = 6. Die S het `n oksidasiegetal 6 in die na2SW4.wenke
- In `n verbinding moet die som van alle oksidasiegetalle gelyk wees aan 0. As daar byvoorbeeld `n ioon is wat 2 atome het, moet die som van die oksidasiegetalle gelyk wees aan die ioniese lading.
- Dit is baie nuttig om te weet hoe om die periodieke tabel van die elemente te lees en waar metale en nie-metale geleë is.
- Atome in hul elementêre vorm het altyd `n oksidasiegetal van 0. `n Monatomiese ioon het `n oksidasiegetal gelyk aan die lading. Die metale van groep 1A in hul elementêre vorm, soos waterstof, litium en natrium, het `n oksidasiegetal van + 1 die metale van groep 2A in hul elementêre vorm, soos magnesium en kalsium, het `n oksidasiegetal van 2. Beide waterstof en suurstof het die moontlikheid om 2 verskillende oksidasiegetalle te neem afhangende van die elemente waaraan hulle gekoppel is.
- Dit sal nuttig wees om die volgende punte te onthou wanneer die verskil tussen oksidasie en reduksie bepaal word:
- Oksidasie verloor (elektrone), reduksie wen (elektrone).
- Verlies van elektrone = oksidasie - toename van elektrone = reduksie.
- Die atome van metale is geneig om elektrone te verloor om positiewe ione (oksidasie) te vorm.
- Die atome van nie-metale is geneig om elektrone te verkry om negatiewe ione (reduksie) te vorm.
- Bestaande ione kan ook elektrone kry of verloor om ione te word met `n ander lading of `n atoom met `n neutrale lading.
Dinge wat jy nodig het
- Periodieke tabel van die elemente
- Internet toegang, chemie boeke of albei
- papier, pen of potlood
- sakrekenaar
Deel op sosiale netwerke:
Verwante












 Hoe om die skakel energie te bereken
Hoe om die skakel energie te bereken Hoe om Organiese Chemie goed te keur
Hoe om Organiese Chemie goed te keur Hoe om chemiese vergelykings te balanseer
Hoe om chemiese vergelykings te balanseer Hoe om `n reduksieoksiedreaksie (redox) te balanseer
Hoe om `n reduksieoksiedreaksie (redox) te balanseer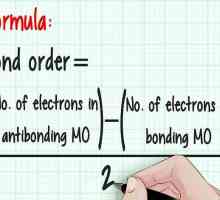 Hoe om die skakelorde in chemie te bereken
Hoe om die skakelorde in chemie te bereken Hoe om die persentasie massa te bereken
Hoe om die persentasie massa te bereken Hoe om die atoommassa te bereken
Hoe om die atoommassa te bereken Hoe om die molêre massa te bereken
Hoe om die molêre massa te bereken Hoe om gram na mol te omskep
Hoe om gram na mol te omskep Hoe om die polariteit van `n molekuul te bepaal
Hoe om die polariteit van `n molekuul te bepaal Hoe om Lewis-puntstrukture te teken
Hoe om Lewis-puntstrukture te teken Hoe om `n atoom te verdeel
Hoe om `n atoom te verdeel Hoe om die atoomgetal te vind
Hoe om die atoomgetal te vind Hoe om valenselektrone te vind
Hoe om valenselektrone te vind Hoe om elektrone te vind
Hoe om elektrone te vind Hoe om elektroniese konfigurasies vir atome van enige element te skryf
Hoe om elektroniese konfigurasies vir atome van enige element te skryf Hoe om `n chemiese vergelyking te skryf
Hoe om `n chemiese vergelyking te skryf Hoe om statiese elektrisiteit te maak
Hoe om statiese elektrisiteit te maak Hoe om chemiese verbindings te noem
Hoe om chemiese verbindings te noem Hoe om die empiriese formule te verkry
Hoe om die empiriese formule te verkry Hoe om in anorganiese chemie te presteer
Hoe om in anorganiese chemie te presteer Hoe om Organiese Chemie goed te keur
Hoe om Organiese Chemie goed te keur Hoe om chemiese vergelykings te balanseer
Hoe om chemiese vergelykings te balanseer Hoe om `n reduksieoksiedreaksie (redox) te balanseer
Hoe om `n reduksieoksiedreaksie (redox) te balanseer Hoe om die skakelorde in chemie te bereken
Hoe om die skakelorde in chemie te bereken Hoe om die persentasie massa te bereken
Hoe om die persentasie massa te bereken Hoe om die atoommassa te bereken
Hoe om die atoommassa te bereken Hoe om die molêre massa te bereken
Hoe om die molêre massa te bereken Hoe om gram na mol te omskep
Hoe om gram na mol te omskep Hoe om die polariteit van `n molekuul te bepaal
Hoe om die polariteit van `n molekuul te bepaal Hoe om Lewis-puntstrukture te teken
Hoe om Lewis-puntstrukture te teken