Hoe om Lewis-puntstrukture te teken
Die teken van die Lewis-puntstrukture (wat ook bekend staan as Lewis-strukture of diagramme) kan verwarrend wees, veral vir studente wat net in die chemie kom. Hierdie strukture help egter om die konfigurasies van die bindings- en valenselektrone van verskillende atome en molekules te verstaan. Die kompleksiteit van die diagramme sal afhang van of jy `n Lewis-struktuur vir `n kovalente diatomiese molekule (twee atome), vir `n groter kovalente molekuul, of vir molekules met ioniese bindings teken.
conținut
stappe
Metode 1
Teken kovalente diatomiese strukture

1
Skryf die simbool van elke atoom. Plaas die twee simbole langs mekaar. Hierdie simbole verteenwoordig die atome wat by die kovalente binding betrokke is. Jy moet genoeg spasie tussen elke atoom verlaat om die skakels en die elektrone te kan teken.
- In die algemeen word kovalente bindings tussen twee nie-metaalelemente gevorm.

2
Bepaal watter mate van binding die twee atome het. Die bande wat by die atome aansluit, kan eenvoudig, dubbel of drievoudig wees, wat gewoonlik bepaal word deur die begeerte van elke atoom om die valensdop met agt elektrone (of met twee in die geval van waterstof) te vul. Om te weet hoeveel elektrone elke atoom sal hê, moet jy die graad van die binding vermenigvuldig deur twee (aangesien elke binding twee elektrone insluit) en dan die aantal elektrone wat nie gedeel word nie, byvoeg.

3
Voeg die skakels by die tekening. Elke skakel word voorgestel deur `n lyn tussen die twee atome. As die skakel eenvoudig is, moet jy net `n lyn teken van die eerste na die tweede atoom. As die skakel dubbel of drievoudig is, moet u onderskeidelik twee of drie reëls teken.

4
Teken die nie-bindende elektrone. In sommige gevalle is dit moontlik dat die valenselektrone van een of albei atome nie by `n verband betrokke is nie. As dit gebeur, moet jy `n punt rondom die ooreenstemmende atoom plaas om elk van sy oorblywende elektrone te verteenwoordig. Die meeste van die tyd, behoort nie een van die atome aan meer as agt elektrone gekoppel te word nie. Om jou werk te hersien, tel elke punt asof dit `n elektron en elke lyn as twee was.
Metode 2
Teken Lewisstrukture vir groter kovalente molekules

1
Bepaal wat die sentrale atoom is. Dit is gewoonlik die laagste elektronegativiteit, sodat dit die grootste kapasiteit het om bande met baie ander atome te vorm. Die term word gebruik "sentrale atoom" omdat al die ander atome in die molekuul aan hierdie atoom gekoppel is, alhoewel hulle nie noodwendig met mekaar verbind is nie.
- Atome soos fosfor en koolstof is gewoonlik sentrale atome.
- Dit is moontlik dat daar meer as een sentrale atoom in die mees komplekse molekules is.

2
Beskou die valenselektrone van die sentrale atoom. As `n algemene reël (hoewel dit nie altyd van toepassing is nie) verkies atome hulself om agt valenselektrone, wat bekend staan as die oktetreël, omring. Wanneer die sentrale atome aan ander atome gekoppel is, sal die mees stabiele konfigurasie meestal dié waarin die oktetreël nagekom word. Op hierdie manier kan u help om vas te stel hoeveel bindings daar tussen die sentrale atoom en die ander atome sal wees, aangesien elke binding twee elektrone verteenwoordig.

3
Skryf die simbool van die sentrale atoom neer. Wanneer u met groter kovalente molekules werk, is dit die beste om eers die sentrale atoom te teken. Vermy om al die atoom simbole op dieselfde tyd te skryf. In plaas daarvan moet jy genoeg ruimte om die sentrale atoom verlaat om die ander simbole te kan plaas nadat jy bepaal het waarheen hulle gaan.

4
Toon die molekulêre geometrie van die sentrale atoom. Vir elke elektron wat nie gedeel word nie, teken twee punte langs mekaar om die sentrale atoom. Vir elke eenvoudige skakel teken `n lyn in die teenoorgestelde rigting na die atoom. Teken vir elke dubbel- of drievoudige skakel twee of drie lyne, onderskeidelik, in plaas van een te teken. Op hierdie manier spoor jy die plekke waarheen ander molekules aan die sentrale atoom gekoppel kan word.

5
Voeg die oorblywende atome by. Elke oorblywende atoom in die molekule sal aansluit by een van die bindings wat uit die sentrale atoom kom. U moet die simbool van elk van hierdie oorblywende atome skryf aan die einde van een van die skakels wat u rondom die sentrale atoom geteken het om aan te dui dat hierdie en die oorblywende atome elektrone deel.

6
Voeg die ander elektrone by. Elke skakel moet as twee elektrone getel word (en dubbel- of drievoudige bande moet as 4 en 6 elektrone onderskeidelik getel word). Voeg dan pare elektrone rondom elke atoom by totdat dit aan die oktetreël voldoen. Om te hersien wat jy in elke atoom gedoen het, kan jy elke punt as een elektron en elke skakel as twee tel. Alles behoort agt te voeg.
Metode 3
Teken Lewisstrukture vir ione

1
Skryf die atoom simbool van die ioon. Dit sal dieselfde simbool wees van die atoom waaruit die ioon gevorm is. Daar moet genoeg spasie rondom die simbool op die papier wees sodat die elektrone en hakies later bygevoeg kan word. Soms is ione poliatomiese molekules (dit is saamgestel uit meer as een atoom) en om hulle te noem, moet die simbole van al die atome wat hulle saamstel, geskryf word.
- Om die simbool vir polyatomiese ione (soos NO3- of SO42-) te maak, moet u die instruksies in die vorige metode volg om Lewis strukture vir groot kovalente molekules te teken.

2
Voeg die elektrone by. Oor die algemeen het atome nie `n negatiewe of positiewe lading omdat hulle neutraal is nie. Hierdie balans tussen die negatiewe en positiewe ladings in die atoom word egter verander wanneer dit elektrone verloor of wen. In hierdie geval word die atoom `n gelaaide deeltjie genoem `n ioon. In Lewis se struktuur moet jy die elektrone voeg wat die atoom gewen het en verwyder diegene wat jy verloor het.

3
Benoem die lading van die ioon. `N vervelige manier om te bepaal of `n atoom beheer het, is om die punte in elke atoom te tel. Maak dit makliker om `n struktuur te lees, moet jy wys as `n ioon het `n lading, waarvoor jy moet die atoom (of poliatomiese) simbool in vierkantige hakies te plaas en dan skryf die las van hulle in die boonste regterkantste hoek.
Deel op sosiale netwerke:
Verwante
 Hoe om die skakel energie te bereken
Hoe om die skakel energie te bereken Hoe om Organiese Chemie goed te keur
Hoe om Organiese Chemie goed te keur Hoe om chemiese vergelykings te balanseer
Hoe om chemiese vergelykings te balanseer Hoe om `n reduksieoksiedreaksie (redox) te balanseer
Hoe om `n reduksieoksiedreaksie (redox) te balanseer Hoe om die skakelorde in chemie te bereken
Hoe om die skakelorde in chemie te bereken Hoe om die persentasie massa te bereken
Hoe om die persentasie massa te bereken Hoe om die atoommassa te bereken
Hoe om die atoommassa te bereken Hoe om die molêre massa te bereken
Hoe om die molêre massa te bereken Hoe om die polariteit van `n molekuul te bepaal
Hoe om die polariteit van `n molekuul te bepaal Hoe om die oplosbaarheid te bepaal
Hoe om die oplosbaarheid te bepaal Hoe om `n atoom te verdeel
Hoe om `n atoom te verdeel Hoe om die oksidasie nommer te vind
Hoe om die oksidasie nommer te vind Hoe om valenselektrone te vind
Hoe om valenselektrone te vind Hoe om elektrone te vind
Hoe om elektrone te vind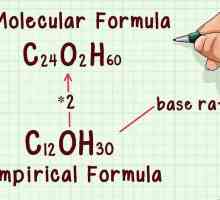 Hoe om die molekulêre formule te vind
Hoe om die molekulêre formule te vind Hoe om elektroniese konfigurasies vir atome van enige element te skryf
Hoe om elektroniese konfigurasies vir atome van enige element te skryf Hoe om `n chemiese vergelyking te skryf
Hoe om `n chemiese vergelyking te skryf Hoe om die basiese beginsels van biochemie te bestudeer
Hoe om die basiese beginsels van biochemie te bestudeer Hoe om chemiese verbindings te noem
Hoe om chemiese verbindings te noem Hoe om `n koolwaterstofketting te benoem met behulp van die IUPAC-metode
Hoe om `n koolwaterstofketting te benoem met behulp van die IUPAC-metode Hoe om in anorganiese chemie te presteer
Hoe om in anorganiese chemie te presteer
 Hoe om Organiese Chemie goed te keur
Hoe om Organiese Chemie goed te keur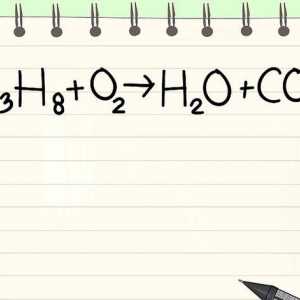 Hoe om chemiese vergelykings te balanseer
Hoe om chemiese vergelykings te balanseer Hoe om `n reduksieoksiedreaksie (redox) te balanseer
Hoe om `n reduksieoksiedreaksie (redox) te balanseer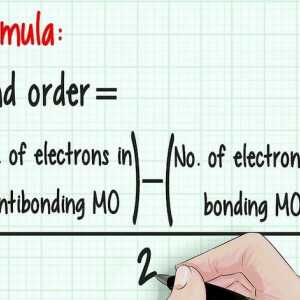 Hoe om die skakelorde in chemie te bereken
Hoe om die skakelorde in chemie te bereken Hoe om die persentasie massa te bereken
Hoe om die persentasie massa te bereken Hoe om die atoommassa te bereken
Hoe om die atoommassa te bereken Hoe om die molêre massa te bereken
Hoe om die molêre massa te bereken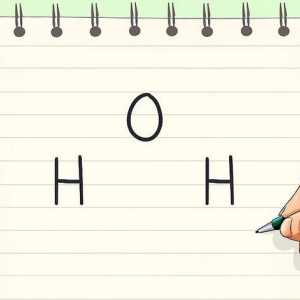 Hoe om die polariteit van `n molekuul te bepaal
Hoe om die polariteit van `n molekuul te bepaal Hoe om die oplosbaarheid te bepaal
Hoe om die oplosbaarheid te bepaal Hoe om `n atoom te verdeel
Hoe om `n atoom te verdeel